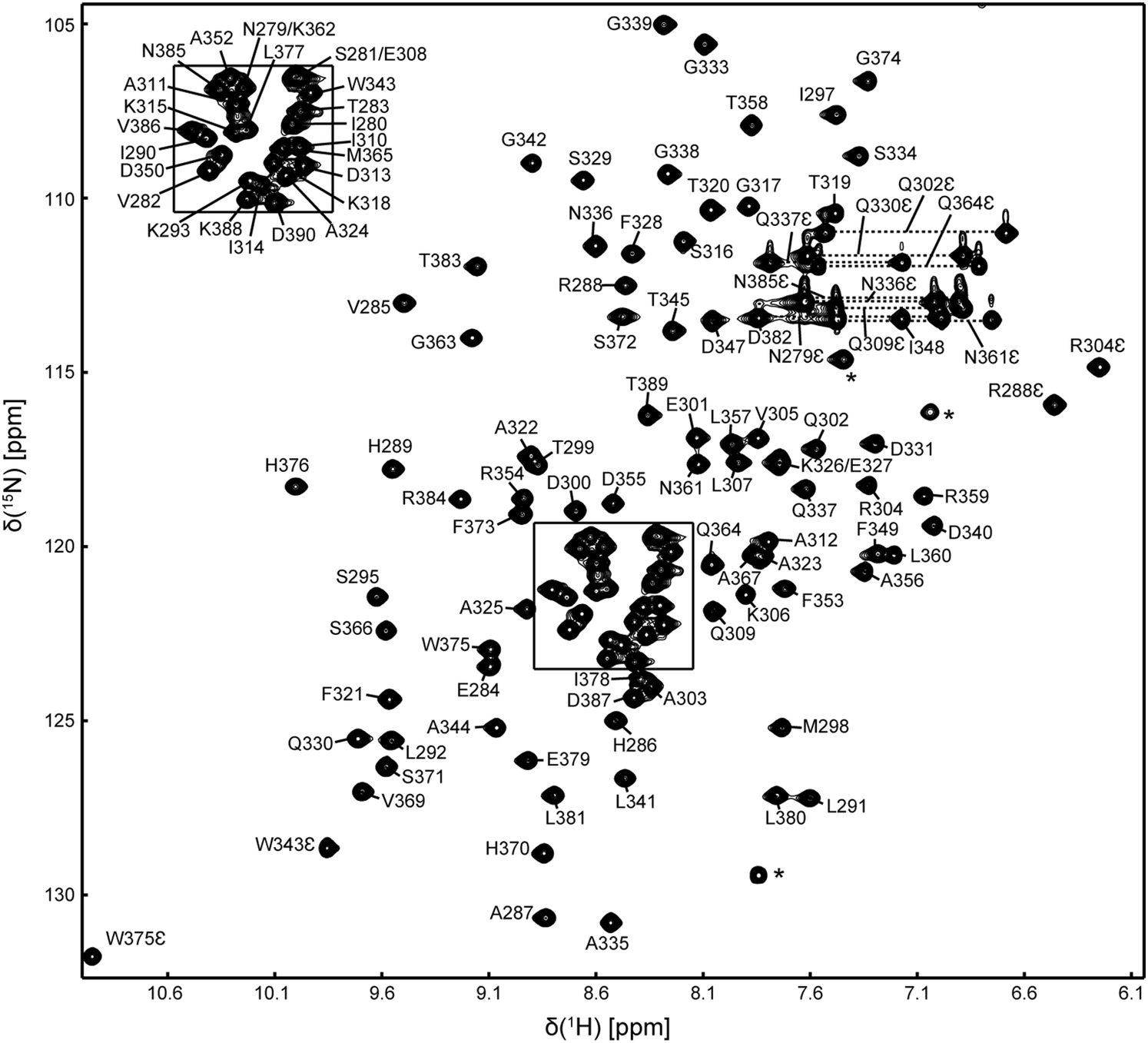
革兰氏阴性菌的膜间质分子伴侣SurA在细菌外膜蛋白的生物合成中起着重要作用,对维持外膜的完整性至关重要。SurA包含一个由N端和C端构成的核心模块,以及两个肽基-脯氨酰基异构酶(PPIase)结构域。SurA的分子伴侣活性依赖于核心模块,而最近的研究表明两个PPIase结构域可能通过较大的构象重排来调控其分子伴侣活性。因此,本篇文章介绍了大肠杆菌SurA的第二个PPIase结构域的1H、13C和15N原子的化学位移归属,为进一步利用核磁共振技术研究该分子的结构、动力学和相互作用提供了非常有价值的信息。
https://link.springer.com/article/10.1007%2Fs12104-019-09874-1